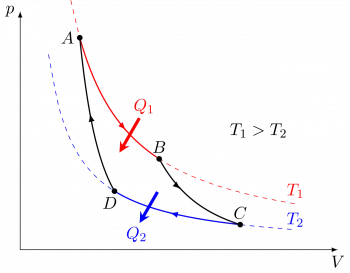
El ciclo de Carnot es un concepto fundamental en la termodinámica y representa un modelo ideal de una máquina térmica reversible que opera entre dos fuentes de calor, una caliente y una fría.
Este ciclo fue propuesto por el físico francés Sadi Carnot en 1824 y es esencial para comprender los límites teóricos de la eficiencia de las máquinas térmicas.
El ciclo de Carnot es un modelo ideal y no se puede lograr completamente en la práctica debido a las inevitables pérdidas y fricciones en los sistemas reales. Sin embargo, sirve como una referencia teórica importante para comprender los límites de la eficiencia de las máquinas térmicas en condiciones ideales.
Etapas del ciclo de Carnot
 El ciclo de Carnot consta de cuatro etapas reversibles que se llevan a cabo en dos procesos isotérmicos (a temperatura constante) y dos procesos adiabáticos (sin transferencia de calor):
El ciclo de Carnot consta de cuatro etapas reversibles que se llevan a cabo en dos procesos isotérmicos (a temperatura constante) y dos procesos adiabáticos (sin transferencia de calor):
-
Proceso isotérmico (calentamiento isócoro): En esta etapa, el sistema (por ejemplo, un gas) se coloca en contacto con una fuente de calor caliente a una temperatura Th y se expande isotérmicamente, manteniendo una temperatura constante durante todo el proceso. Durante este paso, el sistema absorbe calor de la fuente caliente.
-
Proceso adiabático (expansión adiabática): En esta etapa, el sistema se aísla térmicamente, de manera que no hay transferencia de calor con el entorno. El gas continúa expandiéndose, realizando un trabajo sobre el entorno y, como resultado, su temperatura disminuye.
-
Proceso isotérmico (enfriamiento isócoro): El sistema se pone en contacto con una fuente de calor fría a una temperatura Tc. Durante esta etapa, el gas se comprime isotérmicamente, manteniendo una temperatura constante y liberando calor hacia la fuente fría.
-
Proceso adiabático (compresión adiabática): El sistema se aísla térmicamente nuevamente, de modo que no hay transferencia de calor con el entorno. El gas se comprime adiabáticamente, realizando un trabajo sobre el sistema y aumentando su temperatura.
Al completar estas cuatro etapas, el sistema regresa a su estado inicial, y el ciclo puede repetirse.
Eficiencia
La eficiencia del ciclo de Carnot se define como la relación entre el trabajo neto realizado y el calor absorbido de la fuente caliente:
Eficiencia = 1 - (Tc / Th)
Donde Tc es la temperatura de la fuente fría y Th es la temperatura de la fuente caliente.
La eficiencia del ciclo de Carnot es la máxima posible para cualquier máquina térmica operando entre las mismas dos temperaturas Tc y Th.
Máquina de Carnot
Una máquina de Carnot es una máquina térmica reversible que opera entre dos fuentes de calor, una caliente y una fría, y realiza trabajo a partir del flujo de calor entre estas dos fuentes.
Esta máquina teórica se utiliza para ilustrar los principios fundamentales de la termodinámica y establecer los límites teóricos de eficiencia para cualquier máquina térmica.
Ciclo de Carnot inverso
El ciclo de Carnot inverso, también conocido como refrigerador de Carnot o máquina frigorífica de Carnot, es el concepto inverso al ciclo de Carnot clásico.
Mientras que el ciclo de Carnot describe una máquina térmica que convierte calor en trabajo, el ciclo de Carnot inverso describe una máquina frigorífica que realiza trabajo para transferir calor desde una fuente fría hacia una fuente caliente, en contra del flujo natural del calor.
El objetivo principal de un refrigerador o máquina frigorífica es mantener una región o sistema a una temperatura más baja que la temperatura del entorno. Para lograr esto, se necesita un aporte de energía externa (trabajo) para realizar el proceso de enfriamiento.
El ciclo de Carnot inverso consta de cuatro etapas reversibles, al igual que el ciclo de Carnot clásico, pero las direcciones de los procesos son opuestas:
-
Proceso adiabático (compresión adiabática): En esta etapa, el refrigerante se comprime adiabáticamente, lo que aumenta su temperatura y presión. Se realiza un trabajo sobre el refrigerante para comprimirlo.
-
Proceso isotérmico (calentamiento isócoro): El refrigerante se pone en contacto con la fuente caliente a una temperatura Th. Durante este paso, el refrigerante absorbe calor de la fuente caliente, mientras su temperatura permanece constante.
-
Proceso adiabático (expansión adiabática): En esta etapa, el refrigerante se expande adiabáticamente, lo que reduce su temperatura y presión. El trabajo se realiza sobre el sistema para permitir la expansión adiabática.
-
Proceso isotérmico (enfriamiento isócoro): El refrigerante se pone en contacto con la fuente fría a una temperatura Tc. Durante esta etapa, el refrigerante libera calor hacia la fuente fría, manteniendo una temperatura constante.
Al completar estas cuatro etapas, el refrigerante regresa a su estado inicial, y el ciclo puede repetirse para mantener el proceso de enfriamiento.
Importancia del ciclo de Carnot
El ciclo de Carnot es de gran importancia en la termodinámica y la ciencia en general por varias razones fundamentales:
El ciclo de Carnot es de gran importancia en la termodinámica y la ciencia en general por varias razones fundamentales:
1. Establece límites teóricos de eficiencia
Este ciclo proporciona la máxima eficiencia teórica posible para cualquier máquina térmica que opere entre dos fuentes de calor a diferentes temperaturas.
La eficiencia máxima se logra sólo cuando el ciclo es completamente reversible, y este valor máximo está determinado exclusivamente por las temperaturas de las fuentes de calor involucradas.
2. Permite entender la reversibilidad
El ciclo de Carnot es completamente reversible, lo que significa que puede operar en ambas direcciones, tanto como máquina térmica que convierte calor en trabajo como un refrigerador que transfiere calor de una fuente fría a una caliente.
Esta reversibilidad teórica es esencial para entender los conceptos de irreversibilidad y pérdidas de energía en sistemas reales. En la práctica, las máquinas reales son siempre menos eficientes y, por lo tanto, irreversibles en cierta medida.
3. Ayuda en el diseño y mejora de sistemas térmicos
Aunque el ciclo de Carnot es un modelo ideal y no se puede implementar perfectamente en sistemas reales debido a las inevitables pérdidas y fricciones, proporciona una guía valiosa para diseñar y mejorar sistemas térmicos.
Los ingenieros y científicos lo utilizan como referencia para evaluar el rendimiento de máquinas térmicas, como motores y generadores, y sistemas de refrigeración, y para identificar áreas de mejora en la eficiencia.
4. Contribuye al entendimiento de la termodinámica
El ciclo de Carnot es un pilar fundamental de la termodinámica y proporciona una base sólida para el estudio de otros ciclos termodinámicos, como el ciclo Rankine en plantas de energía y el ciclo Brayton en turbinas de gas.
Además, el ciclo de Carnot ayuda a comprender conceptos clave de la termodinámica, como el trabajo, el calor, la entropía y la transferencia de energía en sistemas térmicos.