
La Tercera Ley de la Termodinámica establece que a medida que una sustancia se enfría a una temperatura cercana al cero absoluto (-273.15°C o 0 Kelvin), su entropía, que es una medida del desorden o la incertidumbre en el sistema, se aproxima a un valor constante y finito.
Esta ley postula que alcanzar el cero absoluto requeriría un número infinito de pasos, siendo inalcanzable en la práctica. Además, sugiere que todos los sistemas alcanzarían un estado de máxima orden y mínimo desorden teórico a esa temperatura extrema, lo que tiene implicaciones fundamentales en campos como la física cuántica y el estudio de nuevos materiales con propiedades extraordinarias a temperaturas ultra bajas.
A continuación se muestran algunos ejemplos que ilustran este principio:
Ejemplo 1: Cristales de hielo
 Cuando el agua se enfría a temperaturas muy bajas, próximas al cero absoluto (0 K o -273.15 °C), las moléculas de agua pierden energía cinética y se organizan en una estructura cristalina altamente ordenada, formando hielo. En estas condiciones, la energía térmica es tan baja que las moléculas apenas vibran y adoptan una disposición fija y regular.
Cuando el agua se enfría a temperaturas muy bajas, próximas al cero absoluto (0 K o -273.15 °C), las moléculas de agua pierden energía cinética y se organizan en una estructura cristalina altamente ordenada, formando hielo. En estas condiciones, la energía térmica es tan baja que las moléculas apenas vibran y adoptan una disposición fija y regular.
A medida que la temperatura se acerca al cero absoluto, cualquier desorden térmico residual disminuye, y los cristales de hielo alcanzan un estado de orden máximo, donde la entropía es mínima. Teóricamente, en el cero absoluto, no habría movimiento molecular, y el sistema estaría en su estado de menor entropía posible.
Ejemplo 2: Superconductividad
La superconductividad es un fenómeno de la física que ocurre en ciertos materiales cuando se enfrían por debajo de una temperatura crítica específica. A esta temperatura crítica, los materiales superconductores exhiben una propiedad única: la resistencia eléctrica desaparece por completo permitiendo que la electricidad fluya sin pérdida de energía.
La Tercera Ley de la Termodinámica explica la relación entre la superconductividad y la reducción de la entropía a temperaturas ultra bajas.
En condiciones normales, cuando aplicamos una corriente eléctrica a través de un conductor, como un alambre de cobre, los electrones que transportan la electricidad se enfrentan a obstáculos y choques con los iones del material, lo que genera una resistencia al flujo de electrones. Esta resistencia es la responsable de la pérdida de energía en forma de calor y limita la eficiencia de los dispositivos eléctricos.
Sin embargo, en un material superconductor, a temperaturas muy bajas cercanas al cero absoluto, algo asombroso sucede: los electrones forman "pares de Cooper". Estos pares están compuestos por dos electrones que se unen y se mueven juntos a través del cristal sin experimentar resistencia.
Ejemplo 3: Helio líquido
 El helio es un gas inerte a temperatura ambiente, pero a temperaturas extremadamente bajas, cercanas al cero absoluto, presenta un comportamiento fascinante y único. Cuando se enfría lo suficiente, aproximadamente por debajo de 4.2 K, el helio no se solidifica como otros gases, sino que se convierte en un líquido.
El helio es un gas inerte a temperatura ambiente, pero a temperaturas extremadamente bajas, cercanas al cero absoluto, presenta un comportamiento fascinante y único. Cuando se enfría lo suficiente, aproximadamente por debajo de 4.2 K, el helio no se solidifica como otros gases, sino que se convierte en un líquido.
A medida que el helio se enfría y se convierte en líquido, los átomos de helio pierden energía térmica, lo que reduce su agitación y movilidad. Esta disminución de la energía cinética de los átomos resulta en una significativa reducción de la entropía. En temperaturas aún más bajas, el helio exhibe propiedades cuánticas, como la superfluidez, donde fluye sin fricción alguna.
Al acercarse al cero absoluto, el sistema se aproxima a un estado de orden casi perfecto, donde la entropía tiende a su mínimo.
Ejemplo 4: Condensados de Bose-Einstein
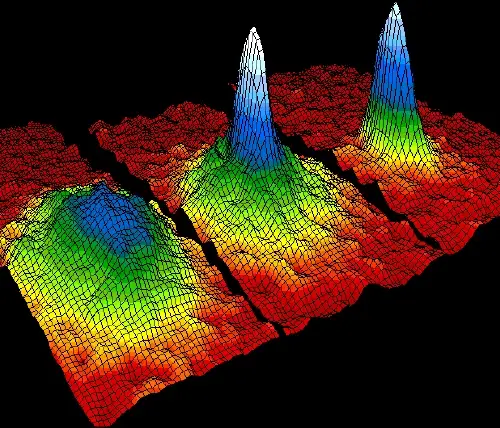 A temperaturas cercanas al cero absoluto, algunos átomos se unen en un estado de agregación especial llamado condensado de Bose-Einstein.
A temperaturas cercanas al cero absoluto, algunos átomos se unen en un estado de agregación especial llamado condensado de Bose-Einstein.
En este estado cuántico, los átomos pierden su individualidad y se comportan como una sola entidad cuántica. Este fenómeno es posible gracias a la Tercera Ley de la Termodinámica, que establece que la entropía disminuye a medida que se alcanzan temperaturas extremadamente bajas.
Este fenómeno fue predicho por Albert Einstein y el físico indio Satyendra Nath Bose en la década de 1920. La idea se basa en la estadística cuántica de Bose-Einstein, que describe el comportamiento de partículas idénticas e indistinguibles, como los fotones de la luz o los átomos que forman ciertos elementos.
En condiciones normales, a temperaturas más altas, las partículas siguen una distribución estadística de Fermi-Dirac (para fermiones) o de Maxwell-Boltzmann (para bosones).
Sin embargo, cuando las partículas se enfrían a temperaturas extremadamente bajas, su comportamiento cuántico colectivo comienza a dominar, y tienden a "colapsar" en el estado de menor energía posible. En este punto, una gran cantidad de partículas ocupa un solo estado cuántico, formando lo que se conoce como el condensado de Bose-Einstein.
En este estado cuántico, las partículas pierden su individualidad y se comportan como una "superpartícula" colectiva, con propiedades cuánticas macroscópicas. Toda la sustancia se convierte en una sola entidad cuántica
Ejemplo 5: Helio sólido
 A temperaturas cercanas al cero absoluto, el helio líquido también puede solidificarse. En su estado sólido, el helio exhibe un comportamiento inusual, como la superfluidez, donde puede fluir sin resistencia a través de capilares extremadamente estrechos, desafiando las leyes clásicas de la física.
A temperaturas cercanas al cero absoluto, el helio líquido también puede solidificarse. En su estado sólido, el helio exhibe un comportamiento inusual, como la superfluidez, donde puede fluir sin resistencia a través de capilares extremadamente estrechos, desafiando las leyes clásicas de la física.
Ejemplo 6: Hielo seco
 El hielo seco es dióxido de carbono (CO₂) en estado sólido a temperaturas mucho más bajas que el punto de congelación del agua. A diferencia del agua, que se congela a 0°C, el CO₂ se solidifica directamente en forma de hielo seco a una temperatura de -78.5°C (-109.3°F) a presión atmosférica normal.
El hielo seco es dióxido de carbono (CO₂) en estado sólido a temperaturas mucho más bajas que el punto de congelación del agua. A diferencia del agua, que se congela a 0°C, el CO₂ se solidifica directamente en forma de hielo seco a una temperatura de -78.5°C (-109.3°F) a presión atmosférica normal.
Cuando el hielo seco se encuentra a temperaturas cercanas al cero absoluto, se comporta de manera similar a otros sólidos a esas temperaturas extremadamente bajas. Las moléculas de CO₂ que forman el hielo seco reducen drásticamente su energía cinética, lo que resulta en una estructura altamente ordenada y una disminución significativa de la entropía. En este estado, el hielo seco alcanzaría su máxima ordenación térmica posible a temperatura ambiente.
El hielo seco es ampliamente utilizado en aplicaciones como refrigerante, en la industria alimentaria, en transporte de materiales sensibles al calor y como efecto especial en el teatro y la industria del entretenimiento.