
Se denomina entropía a la magnitud que indica la energía que no puede realizar un trabajo útil en un proceso termodinámico. En general el universo tiende al desorden. En consecuencia, la entropía , es decir al aumento de la entropía, por lo tanto, la variación positiva de esta magnitud indica el sentido natural en que ocurre cualquier evento en un sistema aislado.
La entropía (S) es una magnitud termodinámica definida originalmente como criterio para predecir la evolución de los sistemas termodinámicos. En todo proceso irreversible, el desorden del sistema aumenta y por lo tanto, la entropía aumenta. Si el proceso es reversible, la variación de entropía es nula.
La entropía de un sistema es una función de estado de carácter extensivo. El valor de esta magnitud física, en un sistema aislado, crece en el transcurso de un proceso que se da de forma natural. El concepto de entropía describe cómo es de irreversible un sistema termodinámico.
¿Qué es la entropía estándar?
La entropía estándar de una composición química es su entropía sometida a 1 atm de presión. Estos valores se expresan en una tabla de entropía que se suelen indicar a una temperatura de 298 K.
Habitualmente, en estas tablas también se expresan las entalpías de formación de los elementos químicos en sus estados estándar establecidos en cero. La entalpía de formación es la cantidad de energía necesaria para formar estas composiciones.
Fórmula de la entropía en la física
En física, la entropía es la magnitud termodinámica que permite calcular la parte de la energía calorífica que no puede utilizarse para producir trabajo si el proceso es reversible. La entropía física , en su forma clásica, es definida por la ecuación propuesta por Rudolf Clausius:
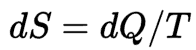
o más simplemente, si la temperatura se mantiene constante en el proceso 1 → 2 ( proceso isotérmico ):
Así, si un cuerpo caliente a temperatura T1 pierde una cantidad de calor Q1, Su entropía disminuye en Q1 / T1, Si cede este calor a un cuerpo frío a temperatura T2 (inferior a T1) la entropía del cuerpo frío aumenta más de lo que ha disminuido la entropía del cuerpo caliente porque
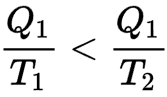
Una máquina reversible puede, por tanto, transformar en trabajo una parte de esta energía calorífica.
Rendimiento de una máquina térmica reversible
El rendimiento que da la máquina reversible indica la relación máxima de energía útil que se puede convertir en trabajo. Esta relación se puede expresar mediante la siguiente fórmula:
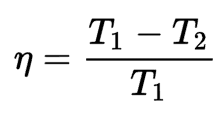
Para que toda la energía calorífica se pudiera transformar en trabajo sería necesario que, o bien el foco caliente se encontrara a una temperatura infinita, o bien que el foco frío estuviera a cero kelvin; en otro caso, el rendimiento termodinámico de la máquina reversible es inferior a 1.
La expresión de la entropía es consecuencia lógica del segundo principio de la termodinámica y de la manera en que se mide la temperatura. La segunda ley de la termodinámica dice que, si no se consume trabajo, el calor fluye de los cuerpos calientes a los cuerpos fríos.
¿Por qué no es posible conocer la entropía absoluta?
En el mundo real no es posible determinar la entropía absoluta por qué requeriría llegar a la temperatura de cero kelvin.
En física siempre se trabaja en variaciones de entropía por qué para conocer el valor absoluto primero sería necesario poder llegar al 0 absoluto. Para llegar al 0 absoluto, el sistema necesitaría enfriarse a cero kelvin para que las moléculas ya no se muevan. A partir de aquí, al aumentar la temperatura aumentaría la entropía.
Sin embargo, desde un punto de vista físico, no es posible llegar a la temperatura de cero kelvin, de acuerdo al teorema de Walther Nernst presentado en la tercera ley de la termodinámica.