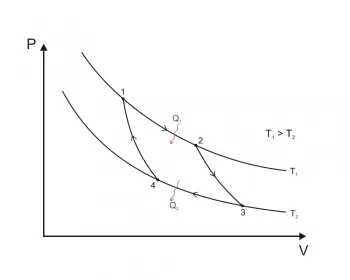
Se denomina proceso termodinámico a la evolución de unas determinadas magnitudes o propiedades en relación a un determinado sistema termodinámico. Estas propiedades se denominan propiedades termodinámicas.
Para poder estudiar un proceso termodinámico se requiere que el sistema esté en equilibrio termodinámico en el punto inicial y final del proceso. Es decir, que las magnitudes que sufren una variación al pasar de un estado a otro deben estar completamente definidas en sus estados inicial y final. Un sistema termodinámico está en principio en un estado de equilibrio termodinámico cuando las variables principales del sistema permanecen invariables. Es decir, la presión, el volumen y la temperatura no experimentan se mantienen constantes con el paso del tiempo.
Un proceso termodinámico también puede ser visto como los cambios de un sistema, desde unas condiciones iniciales hasta otras condiciones finales.
Un proceso termodinámico puede ser reversible o irreversible. Todas las transformaciones reales son irreversibles, ya que las fricciones no se pueden eliminar por completo, por lo que la condición de reversibilidad es solo una aproximación teórica.
La teoría de los procesos térmicos se aplica al diseño de motores, unidades de refrigeración, industria química y meteorología.
Tipos de procesos termodinámicos
Los principales tipos de procesos termodinámicos son los siguientes:
- Proceso isobárico: tiene lugar a presión constante. En otras palabras, el sistema está dinámicamente conectado, con una frontera movible, a un depósito a presión constante. Cuando un gas perfecto evoluciona isobáricamente desde un estado A hasta un estado B, la temperatura y el volumen asociados siguen la ley de Charles.
- Proceso isocórico: el volumen permanece constante. Por lo tanto, si el sistema está a volumen constante, el trabajo hecho por el sistema será cero. Esto implica que el proceso no realiza trabajo presión-volumen. De ello se desprende que, cualquier energía térmica transferida al sistema externamente, éste lo absorbe en forma de energía interna.
- Proceso isotérmico (o proceso isotermo): tiene lugar a temperatura constante. En otras palabras, el sistema está conectado térmicamente, por una frontera térmicamente conductora, a un depósito de temperatura constante.
- Proceso adiabático: es un proceso en el que no hay transferencia de calor. Para un proceso reversible, esto es idéntico a un proceso isentrópico. Se puede decir que el sistema está térmicamente aislado de su entorno y que no puede intercambiar calor con el entorno.
- Proceso isentrópico: tiene lugar a entropía constante. Para un proceso reversible, esto es idéntico a un proceso adiabático.
- Proceso de potencial químico constante: el sistema es conectado por transferencia de partículas con una frontera permeable a las partículas.
- Proceso de número de partículas constante: no hay energía añadida o sustraída del sistema por transferencia de partículas. Se puede decir que el sistema es aislado por transferencia de partículas de su entorno por una frontera permeable a las partículas.
- Proceso politrópico: un proceso politrópico es un proceso termodinámico durante el cual la capacidad calorífica de un gas permanece sin cambios, es decir, no existen intercambios de calor.
Ejemplos cotidianos
A continuación te presentamos algunos ejemplos de procesos termodinámicos cotidianos:
- Calentador solar de agua (proceso isotérmico): Un calentador solar de agua es un dispositivo que utiliza la radiación solar para calentar el agua. Durante el día, la luz solar incide sobre un colector solar, calentando un fluido (como agua o un líquido anticongelante) que circula por él. Este proceso se puede considerar isotérmico porque la temperatura se mantiene relativamente constante durante la absorción de la energía solar.
- Cocción de alimentos (proceso isotérmico): Cuando cocinas alimentos, como hirviendo agua para hacer pasta, estás experimentando un proceso isotérmico, donde la temperatura se mantiene constante. Durante este proceso, la energía térmica se transfiere al agua, causando un aumento en la temperatura y permitiendo la cocción de los alimentos.
- Inflar un globo (proceso adiabático): Al inflar un globo, estás realizando un proceso adiabático, ya que ocurre sin transferencia de calor hacia el sistema ni desde él. El aire dentro del globo se comprime rápidamente al inflarlo, lo que aumenta su temperatura.
- Refrigeración de alimentos en el refrigerador (proceso isobárico): Cuando colocas alimentos calientes en el refrigerador, estás experimentando un proceso isobárico, donde la presión se mantiene constante. La energía térmica se transfiere desde los alimentos al ambiente más frío del refrigerador, enfriándolos gradualmente.
- Calentamiento del automóvil (proceso isocórico): Al arrancar un automóvil en un día frío, el proceso de calentamiento del motor puede considerarse isocórico, ya que el volumen de los gases en el cilindro permanece constante. La temperatura aumenta debido a la combustión del combustible.
- Uso de un aerosol (expansión libre): Cuando se libera el contenido de un aerosol, como desodorante o pintura en aerosol, se produce una expansión libre. No hay transferencia de calor significativa durante este proceso, y la liberación rápida del contenido se debe a la presión acumulada.