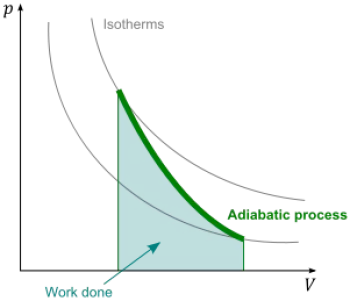
Se denomina proceso adiabático a un proceso termodinámico en el que un sistema no intercambia calor con su entorno. Esto implica que el calor que entra o sale del sistema es nulo, es decir, la variación de energía interna del sistema se debe únicamente al trabajo realizado sobre él o por él.
El término "adiabático" se refiere a aquellos elementos o condiciones que impiden el intercambio de calor con el entorno, como, por ejemplo, una pared adiabática que no permite la transferencia de calor.
La suposición de que un proceso es adiabático se utiliza con frecuencia como una aproximación simplificadora en muchos análisis termodinámicos, ya que facilita los cálculos. Sin embargo, en la práctica, no existen sistemas perfectamente adiabáticos, aunque se puede aproximar a ellos en muchos casos.
El concepto de proceso adiabático es fundamental para entender y aplicar la primera ley de la termodinámica, ya que establece la relación entre el calor, el trabajo y la energía interna de un sistema en ausencia de transferencia de calor.
Ejemplos de procesos adiabáticos
A continuación te presento algunos ejemplos de procesos adiabáticos en diferentes sistemas termodinámicos:
Expansión y compresión en un cilindro con gas
 En un motor de combustión interna, la mezcla de aire y combustible se comprime adiabáticamente cuando el pistón se mueve hacia arriba en el cilindro.
En un motor de combustión interna, la mezcla de aire y combustible se comprime adiabáticamente cuando el pistón se mueve hacia arriba en el cilindro.
Este proceso de compresión aumenta la temperatura del gas debido a la compresión rápida y sin pérdida de calor hacia el entorno. Al final del ciclo, cuando el pistón se mueve hacia abajo, el gas se expande adiabáticamente, realizando trabajo sobre el pistón sin que se produzca un intercambio de calor con el entorno.
Flujo de gas a través de una tobera (boquilla de Laval)
En un motor a reacción, los gases de escape se aceleran al pasar por una tobera, lo que provoca una expansión adiabática.
Durante este proceso, el gas se expande rápidamente, aumentando su volumen y reduciendo su presión, sin intercambiar calor con el entorno. La energía interna del gas se convierte en energía cinética, lo que permite que el gas acelere a altas velocidades, generando el empuje necesario para propulsar el avión.
Descenso de aire en la atmósfera (calentamiento adiabático)
Cuando una masa de aire desciende en la atmósfera, como ocurre en fenómenos meteorológicos como el foehn o el chinook, el aire se comprime adiabáticamente.
Este proceso provoca que la temperatura del aire aumente sin que haya transferencia de calor desde el entorno.
Este tipo de calentamiento contribuye en la formación de vientos cálidos que afectan regiones montañosas y en la previsión de fenómenos climáticos.
Refrigeradores y sistemas de aire acondicionado
En un sistema de refrigeración, como el aire acondicionado, el gas refrigerante experimenta una expansión adiabática al pasar por la válvula de expansión.
En este proceso, la presión y la temperatura del gas disminuyen rápidamente sin intercambiar calor con el entorno.
Producción de sonido en gases
Las ondas sonoras viajan a través del aire mediante procesos adiabáticos. A medida que la onda de sonido se propaga, las partículas del aire se comprimen y expanden rápidamente, sin tiempo para que ocurra un intercambio significativo de calor.
Expansión de un globo de helio
Al liberar un gas de helio en un globo, el gas se expande adiabáticamente. Si el globo sube en la atmósfera, el helio se expande sin intercambiar calor con el entorno, ya que el proceso es muy rápido.
La expansión adiabática del helio en el globo reduce su presión y temperatura, lo que le permite ascender.
Compresión de aire en un compresor de aire
En un compresor de aire, el aire es comprimido adiabáticamente cuando se introduce en un volumen más pequeño. Este proceso eleva la temperatura del aire sin permitir que el calor se disipe al ambiente, lo que hace que el aire se caliente considerablemente.
La energía que se utiliza para comprimir el aire aumenta su energía interna, lo que puede utilizarse más tarde en aplicaciones como la acción de herramientas neumáticas o en sistemas de refrigeración.
Pistón en un motor Stirling
 En un motor Stirling, el gas dentro de los cilindros se expande adiabáticamente durante la fase de trabajo. A medida que el gas se expande, se realiza trabajo sobre el pistón, pero no se intercambia calor con el entorno.
En un motor Stirling, el gas dentro de los cilindros se expande adiabáticamente durante la fase de trabajo. A medida que el gas se expande, se realiza trabajo sobre el pistón, pero no se intercambia calor con el entorno.
Este tipo de motor aprovecha las variaciones de temperatura en un ciclo adiabático para generar energía de manera eficiente, aunque se requieren mecanismos adicionales para el intercambio de calor en otras fases del ciclo.
Conceptos relacionados
-
Un proceso isentrópico es un proceso adiabático que además es reversible. En este caso, el sistema también mantiene constante la entropía, lo que lo convierte en un proceso ideal para diversas aplicaciones en ingeniería.
-
Una pared adiabática es aquella que no permite la transferencia de calor entre el sistema y su entorno. En la práctica, una pared aislada puede aproximarse a las condiciones de una pared adiabática, aunque no de manera perfecta.
-
Un sistema adiabático es aquel en el que no se permite el intercambio de calor con el exterior. Este concepto es clave en la modelización de diversos procesos termodinámicos y es comúnmente utilizado en la ingeniería y la física.
Calentamiento y enfriamiento adiabático
La compresión adiabática de un gas provoca un aumento en la temperatura. También aumenta la energía interna del gas. La expansión adiabática causa una bajada en la temperatura.
En ambos procesos la energía del sistema permanece constante. No hay ni incremento ni pérdida de calor. Por el contrario, la expansión libre es un proceso isotérmico para un gas ideal.
Tales cambios de temperatura pueden cuantificarse utilizando:
- La ley de los gases ideales.
- La ecuación hidrostática para los procesos atmosféricos.
El calentamiento adiabático ocurre cuando la presión de un gas aumenta debido al trabajo realizado sobre ella por su entorno.
El enfriamiento adiabático ocurre cuando la presión sobre un sistema adiabáticamente aislado disminuye. Esta disminución permite que se expanda. Al aumentar el volumen, baja la temperatura y su energía interna.