En termodinámica, un proceso isobárico es un cambio en el estado de una cierta cantidad de materia en la que la presión permanece constante. Lo que sí cambia es una o más de sus variables de estado, como el volumen y la temperatura. Si se transfiere calor al sistema, se realiza trabajo y también cambia la energía interna del sistema.
El proceso isobárico para gases ideales sigue la ley de Charles. Según esta ley, para una masa fija de gas ideal a presión constante, el volumen es directamente proporcional a la temperatura en Kelvin.
Los procesos isobáricos se rigen por la primera ley de la termodinámica. En estos procesos, el incremento de la entalpía (ΔH) es igual al calor transferido al sistema, y el trabajo realizado es P·ΔV. La relación entre la energía interna, el trabajo y el calor se expresa como ΔU=Q−PΔV, siendo Q=ΔH.
Definición de un proceso isobárico
Un proceso isobárico es aquel en el que la presión se mantiene constante mientras el sistema experimenta otros cambios. En términos más técnicos, se dice que la derivada de la presión con respecto al tiempo es igual a cero, es decir:
dP/dt=0
Este tipo de proceso se diferencia de otros procesos termodinámicos, como los procesos isocóricos (en los que el volumen es constante), los procesos isotérmicos (en los que la temperatura es constante) y los procesos adiabáticos (en los que no hay transferencia de calor).
Aunque la presión se mantiene constante, otras propiedades del sistema, como el volumen y la temperatura, pueden cambiar. A medida que el volumen del sistema cambia, se realiza trabajo, y este trabajo está relacionado con la variación de volumen bajo una presión constante.
Ejemplos de procesos isobáricos
Para comprender mejor este proceso termodinámico nos ayudará ver algunos de ejemplos.
Calentamiento del aire de un globo
El cambio de volumen que experimenta un globo conforme los rayos del sol inciden sobre él es un ejemplo de proceso isobárico.
Al inicio de la mañana presenta cierta presión, volumen y temperatura, conforme se calienta el aire en su interior aumenta la presión, pero esta no varía debido al aumento de su volumen.
Fase de expansión del cilindro de un motor térmico
La expansión de aire en un cilindro con un pistón movible al que se suministra calor se realiza mediante un proceso isobárico.
El volumen aumentará de forma proporcional a su temperatura y la presión se mantendrá constante. Esto está de acuerdo con la ley de Charles.
Ebullición de agua en un recipiente abierto
Un ejemplo cotidiano de un proceso isobárico se presenta al hervir agua en un recipiente abierto. Al suministrar energía calorífica al agua, ésta sube de temperatura y se convierte en vapor.
El vapor que se obtiene tiene una temperatura superior y ocupa un mayor volumen, sin embargo, la presión se mantiene constante. Desde el inicio la presión es igual a la presión atmosférica.
Sistemas isobáricos
Un sistema isobárico es un tipo de sistema termodinámico en el cual la presión permanece constante durante todos los procesos que ocurren en él.
Imagina, por ejemplo, una olla con una tapa ajustada de manera que el contenido puede expandirse o contraerse sin cambiar la presión interna. La olla está abierta al ambiente, de modo que la presión en su interior será siempre la misma que la presión atmosférica.
En este tipo de sistema, aunque la presión se mantenga estable, otros factores como el volumen y la temperatura del contenido pueden cambiar.
Esto ocurre porque el sistema responde a cualquier aumento de temperatura ajustando su volumen para mantener la presión constante. Así, si calientan el contenido, el volumen aumentará para compensar, mientras que si enfrían el sistema, el volumen se reducirá.
Ley de los gases ideales y procesos isobáricos
Para entender completamente los procesos isobáricos, es útil considerar la ecuación de estado de los gases ideales, que establece una relación entre la presión (P), el volumen (V), la temperatura (T) y la cantidad de gas (n) en moles, según la ecuación:
P·V=n·R·T
Donde R es la constante de los gases ideales. En un proceso isobárico, la presión P es constante; esto implica que, bajo condiciones de presión constante, el volumen de un gas ideal es directamente proporcional a su temperatura.
Si la temperatura de un gas aumenta en un proceso isobárico, su volumen también aumentará proporcionalmente, y si la temperatura disminuye, el volumen se reducirá.
Esta relación es una forma de la ley de Charles, que es un caso particular de la ley de los gases ideales para un proceso isobárico.
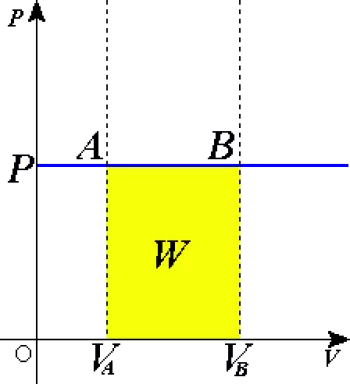
Trabajo realizado en un proceso isobárico
 Uno de los aspectos más importantes de los procesos isobáricos es el trabajo realizado por o sobre el sistema durante el proceso.
Uno de los aspectos más importantes de los procesos isobáricos es el trabajo realizado por o sobre el sistema durante el proceso.
En un proceso termodinámico, el trabajo realizado por el sistema se define como:
W=∫P·dV
En un proceso isobárico, donde la presión es constante, esta ecuación se simplifica a:
W=P·ΔV
Donde ΔV es el cambio en el volumen del sistema. Si el volumen aumenta, el sistema realiza trabajo sobre su entorno, lo que significa que el gas está expandiéndose. Si el volumen disminuye, el entorno realiza trabajo sobre el sistema, comprimiendo el gas.
Este trabajo realizado está estrechamente vinculado al cambio en la energía interna y al calor añadido o retirado del sistema, según la segunda ley de la termodinámica, que establece:
ΔU=Q−W
Donde:
- ΔU es el cambio en la energía interna del sistema.
- Q es el calor añadido al sistema.
- W es el trabajo realizado por el sistema.
En un proceso isobárico, el calor añadido al sistema no solo cambia la energía interna del sistema, sino que también se convierte en trabajo debido al cambio en el volumen. Esta característica es diferente de un proceso isocórico, donde todo el calor añadido se convierte en energía interna, ya que no se realiza trabajo en un sistema de volumen constante.