La segunda ley de la termodinámica establece que: “La cantidad de entropía del universo tiende a incrementarse en el tiempo.”
Del segundo principio se extrae que si bien todo el trabajo se puede convertir en calor, no todo el calor puede convertirse en trabajo. La máxima eficiencia que se puede conseguir es la eficiencia de Carnot.
De acuerdo con la primera ley de la termodinámica, todo proceso que ocurre en un sistema dado debe satisfacer el principio de conservación de la energía, incluyendo el flujo de calor.
La ecuación: ![]()
establece, en otras palabras,que todo proceso cuyo único fin sea el de crear o destruir energía, es imposible, esto es, niega la existencia de una máquina de movimiento perpetuo de primera clase.
El primer principio de la termodinámica no nos dice nada acerca de la dirección en que un proceso puede ocurrir en un sistema.
La entropía y el segundo principio de la termodinámica
En la segunda ley de la termodinámica es muy importante el concepto de la entropía.
La segunda ley requiere que, en general, la entropía total de cualquier sistema no pueda disminuir más que aumentando la entropía de algún otro sistema.
Por lo tanto, en un sistema aislado de su entorno, la entropía de ese sistema tiende a no disminuir. Por esta razón el calor no puede fluir de un cuerpo más frío a un cuerpo más caliente sin la aplicación del trabajo (la imposición del orden) al cuerpo más frío.
Se deduce que una reducción en el aumento de entropía en un proceso específico, como una reacción química, significa que es energéticamente más eficiente.
La aplicabilidad de una segunda ley de la termodinámica se limita a los sistemas que están cerca o en estado de equilibrio.
Ejemplos de la segunda ley de la termodinámica
Esta restricción en la dirección, en que un proceso puede o no ocurrir en la naturaleza, se manifiesta en todos los procesos espontáneos o naturales. En efecto, siempre observamos que:
-
Un gas comprimido tiende a expandirse
-
La transferencia de calor siempre sucede desde los cuerpos calientes a los fríos.
-
El funcionamiento de un aire acondicionado
Nunca observamos que estos procesos ocurran en forma espontánea en dirección opuesta. En ningún caso el calor fluye de un cuerpo frío a otro caliente sin la aportación de un trabajo externo.
¿Cómo funciona un aire acondicionado?
Un aire acondicionado puede enfriar el aire en una habitación. Al enfriar el aire reduce la entropía del aire de ese sistema.
El calor expulsado de la habitación (el sistema) siempre contribuye más a la entropía del ambiente que la disminución de la entropía del aire de ese sistema. Por lo tanto, el total de entropía de la sala más la entropía del entorno aumenta.
Máquinas térmicas
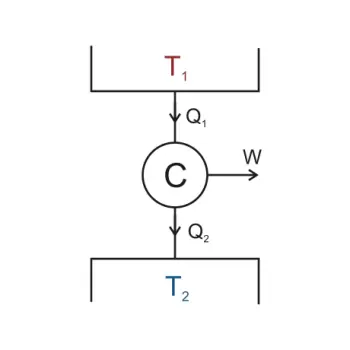
En teoría, una máquina térmica con una eficiencia perfecta debería convertir toda la energía calorífica absorbida en trabajo mecánico. La segunda ley de la termodinámica establece que esto es imposible.
Definición de máquinas térmicas
Un máquina térmica tiene por objetivo proporcionar continuamente trabajo al exterior a partir del calor absorbido.
Si imaginamos un ciclo realizado en sentido opuesto al de un motor, el resultado final será:
-
La absorción de calor a temperatura baja.
-
La expulsión de una cantidad mayor a temperatura más elevada
-
Y por fin, la realización de una cantidad neta de trabajo sobre el sistema.
Teorema de Carnot
El teorema de Carnot anuncia que “Ninguna máquina térmica operando en ciclos entre dos recipientes térmicos dados, tiene una eficiencia mayor que la de una máquina reversible (de Carnot) operando entre los mismos recipientes”
La demostración, es debida a W. Thomson, (Lord Kelvin). Adicionalmente se encuentra el Teorema de Kelvin Planck: “Toda transformación cíclica, cuyo único resultado final sea el de absorber calor de un cuerpo o fuente térmica a una temperatura dada y convertirlo íntegramente en trabajo, es imposible.”


